Fallpräsentation
Oral-B Preis für die beste Fallpräsentation 2023
Rettung einer Unterkieferfront dank Kompositschienung
Systematische Parodontitistherapie - Stadium III, Grad C
Dr. med. dent. (HU) Tobias M. Janson
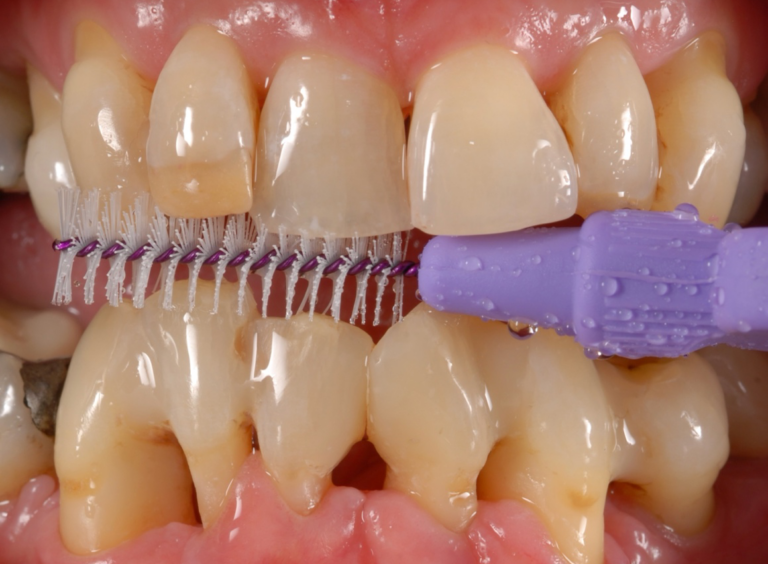
Abbildung 1 Klinisches Foto nach Abschluss der aktiven Therapie
Akuttherapie
Die Patientin stellte sich am 23.08.2021 nach spontaner Avulsion von Zahn 31 – sehr besorgt um den Erhalt ihrer Zähne – im Notdienst des Zentrums für Zahnmedizin der Universität Zürich vor. Um einem weiteren Zahnverlust vorzubeugen wurden die stark gelockerten Zähne der Unterkieferfront zunächst geschient (Abb. 2).

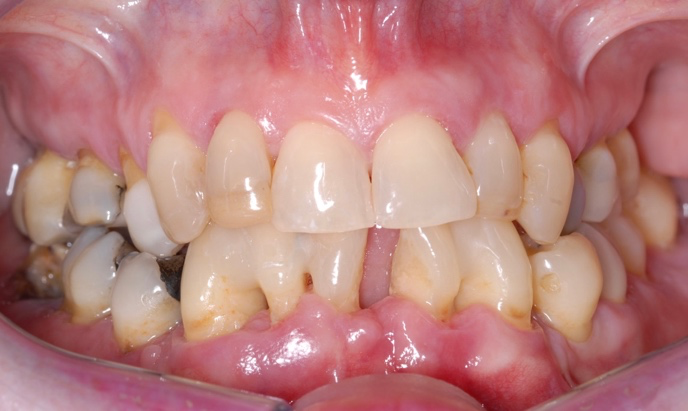
Abbildung 2 Klinische Situation zum Zeitpunkt der Erstvorstellung (23.08.2021), links vor und rechts nach der Schienung
Anamnese
Als Behandlungswunsch stand der Zahnerhalt im Vordergrund. Allgemeinmedizinisch war die 64-jährige Patientin gesund, Nicht-Raucherin und nahm keine Medikamente ein. Zahnärztliche Kontrollen und professionelle mechanische Plaque Entfernungen (PMPR) wurden bisher halbjährlich durchgeführt, während hingegen nie eine systematische Parodontitistherapie vorgeschlagen wurde. Um eine gute häusliche Mundhygiene bemüht nutzte sie bisher zweimal täglich eine Handzahnbürste, sowie Interdentalbürsten und Zahnseide.
Diagnose & Prognose
Im Rahmen einer umfassenden Befundaufnahme wurde eine generalisierte Parodontitis Stadium III Grad C diagnostiziert [1]. Entscheidend waren hierfür der generalisierte klinische Attachment- und radiologische Knochenverlust bis über das apikale Drittel (Abb. 3 u. 4). Überwiegend hohe Sondierungstiefen (≥ 6mm), horizontale Furkationsbeteiligungen bis Grad II, als auch Lockerungsgrade mit sekundären okklusalen Traumata und ausgeprägte Rezessionen erhöhten die Komplexität [2, 3] (Abb. 5). Noch weitestgehend geschlossene Zahnreihen und der Umstand, dass es trotz der vorhandenen parodontalen Destruktionen noch nicht zum Verlust der Kaufunktion gekommen ist, begründete die Einordnung im Stadium III [1, 4]. Der Vergleich aktueller Röntgenbilder mit Aufnahmen aus früheren Behandlungen lieferte direkte Evidenz für die Bestimmung der Progression. Eine nachgewiesene hohe Menge parodontopathogener Keime, sowie die Detektion von Aggregatibacter actinomycetemcomitans ergänzten den Befund (Abb. 6). Der Zahn 47 zeigte eine frakturierte, kariöse Krone und apikale Ostitis. Gemäß der klinikinternen Einzelzahnprognose wurden Zähne mit Sondierungstiefen von ≥ 6mm, Furkationsbeteiligungen von ≥ Grad II und infraossären Knochendefekten zunächst als zweifelhaft eingestuft. Lediglich die Zähne 18 und 38 wurden aufgrund fehlender Antagonisten als nicht erhaltungswürdig (Funktion) bewertet. Insgesamt wurde die Prognose für die Gesamtbehandlung als günstig betrachtet, da die Patientin keine bekannten systemischen Risikofaktoren aufwies und sich sehr motiviert für zukünftige Mitarbeit zeigte. Allerdings könnten sich die Furkationsinvolvierungen mit geringen Wurzeldivergenzen negativ auswirken [5].
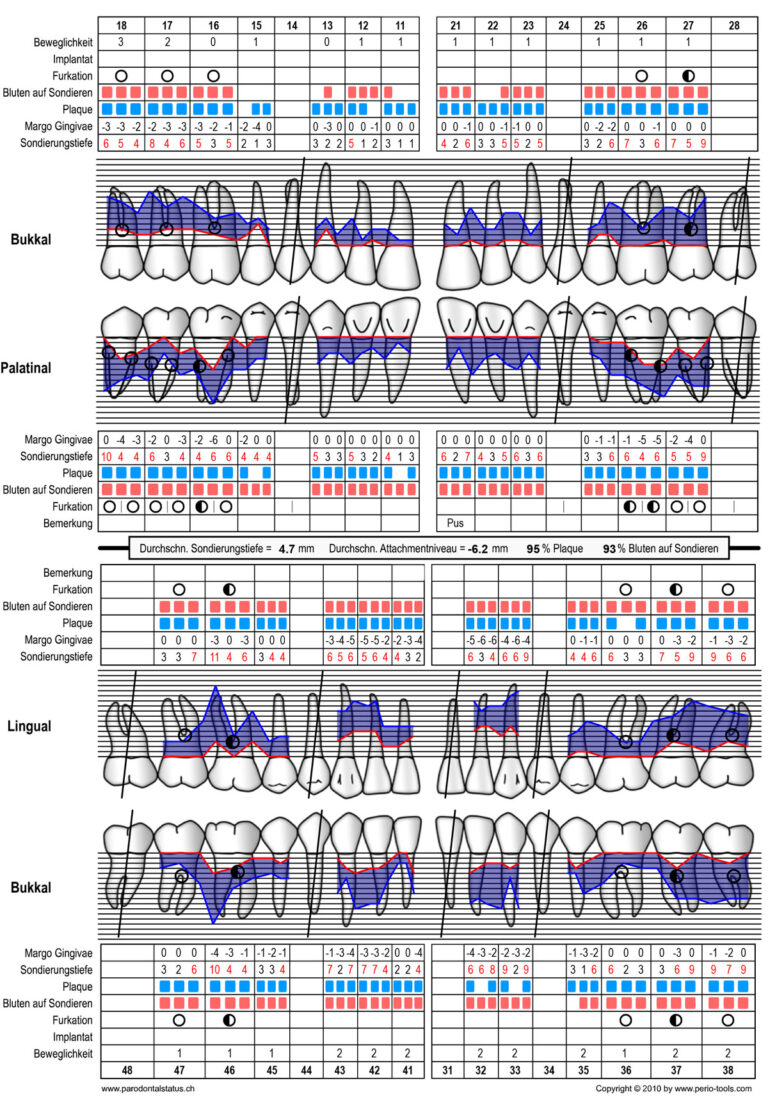
Abbildung 3 Parodontalstatus mit BoP [6] und Plaquestatus [7] zum Zeitpunkt der Befundaufnahme (23.10.2021)
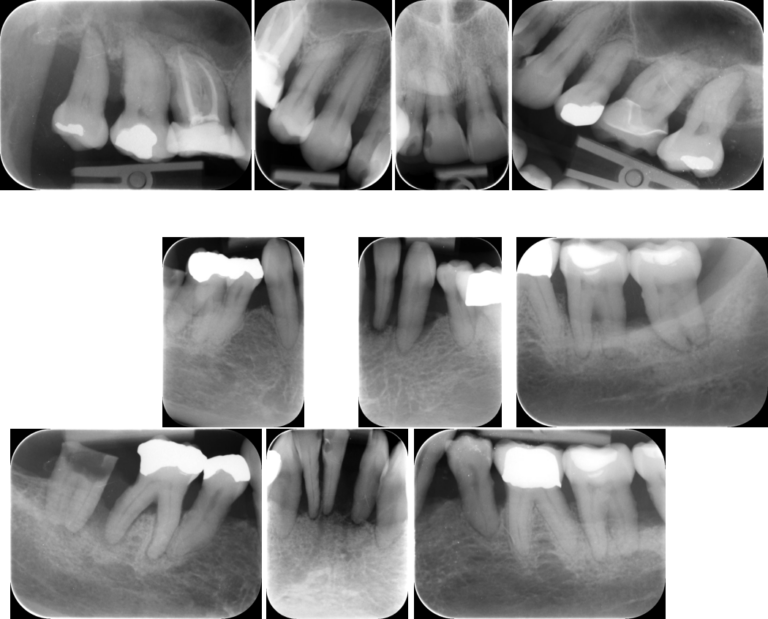
Abbildung 4 Röntgenstatus zum Zeitpunkt der Befundaufnahme (23.10.2021)
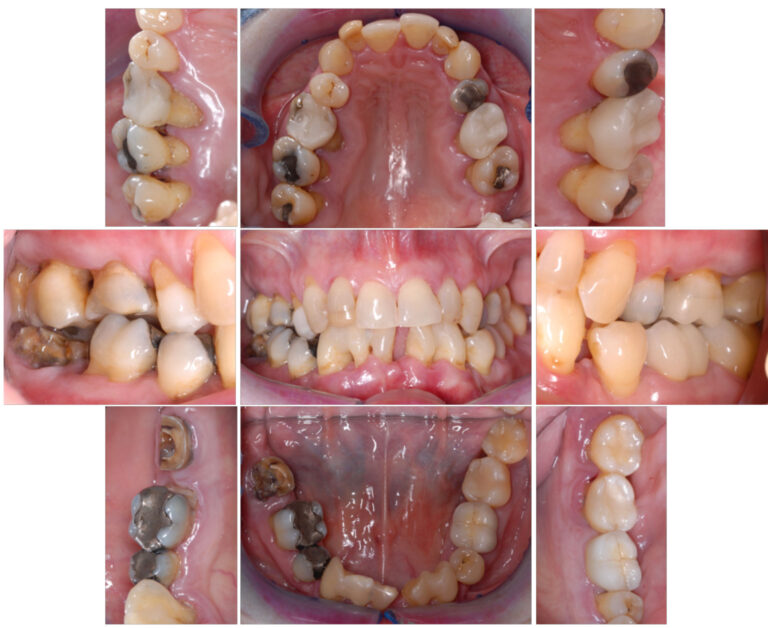
Abbildung 5 Klinische Bilder zum Zeitpunkt der Befundaufnahme (28.10.2021)
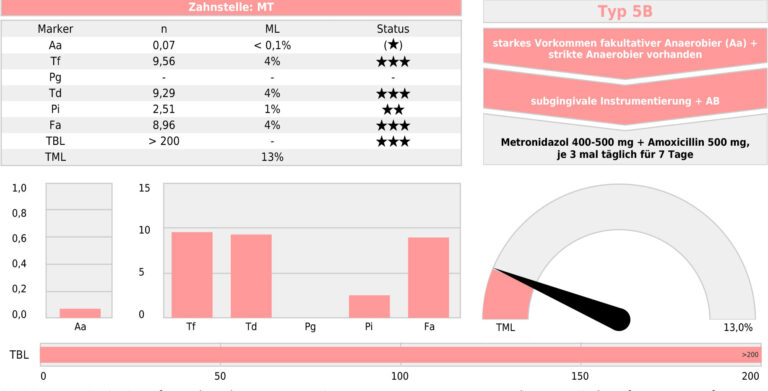
Abbildung 6 Mikrobiologischer Befund (Aa = Aggregatibacter actinomycetemcomitans; Tf = Tanerella forsythia; Pg = Porphyromonas ; Td = Treponema denticola; Pi = Prevotella intermedia; Fa = Filifactor alocis; TBL Total Bacterial Load, Gesamtkeimzahl; TML Total Marker
Die Therapie wurde entsprechend des Stufenschemas der EFP-Leitlinie geplant und durchgeführt [8].
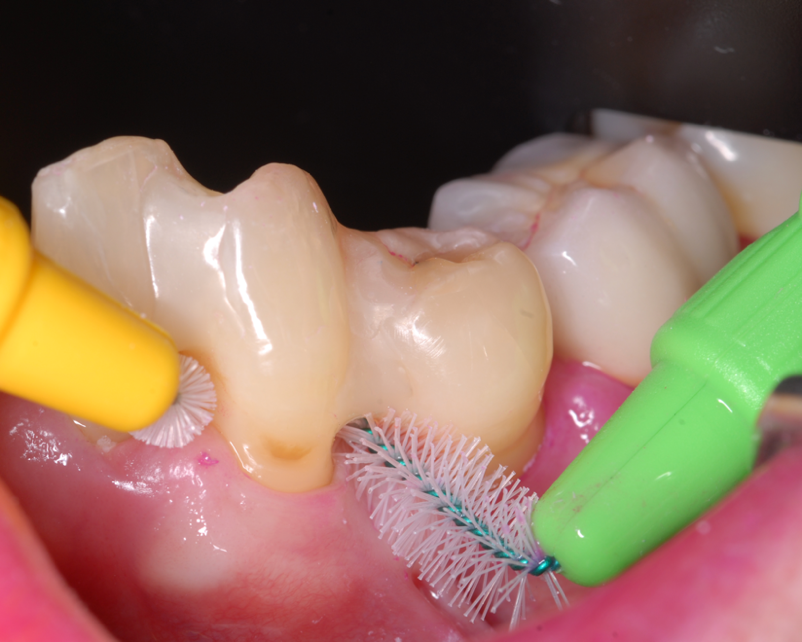
Abbildung 7 Interdentale Schienung 35 auf 32 und deren Mundhygienefähigkeit mit verschiedenen Interdentalbürstchen
Stufe 1 – Kontrolle von Risikofaktoren und des supragingivalen Biofilms
Die Therapie wurde mit einer ausführlichen Aufklärung der Patientin begonnen. Anschließend wurden individuelle Maßnahmen – in diesem Fall die Verwendung einer elektrischen Zahnbürste, einer Einzelbüschelbürste und verschiedener Interdentalbürsten – zur Durchführung der häuslichen Mundhygiene mit der Patientin erprobt[9]. Aufgrund des erhöhten Lockerungsgrades von Zahn 35 und der Dadurch eingeschränkten Kaufunktion der Patientin wurde dieser in die Schienung der benachbarten Zähne einbezogen (Abb. 7). An den Zähnen 35 und 37 wurden aufgrund sekundärer okklusaler Traumata okklusale Korrekturen durchgeführt. In zwei weiteren Sitzungen folgte die Überprüfung des Erfolgs der Mundhygieneinstruktionen mit Hilfe von Plaquerelevatoren, als auch eine weitere Ermutigung und Instruktion der Patientin [10]. Darüber hinaus wurde der Zahn 47 aufgebaut und nach mechanischer Aufbereitung mit einer Kalziumhydroxideinlage versorgt.
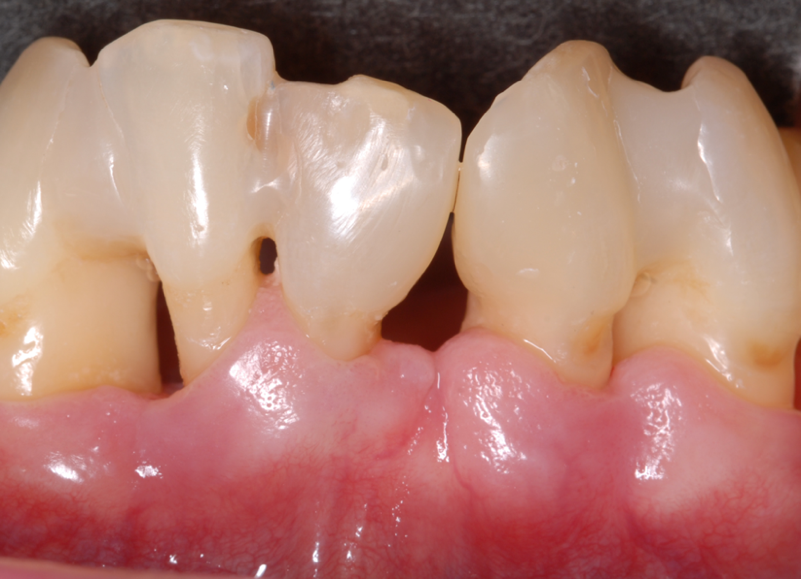
Abbildung 8 Diastemaschluss zur provisorischer Versorgung Lücke 31
Stufe 2 – Subgingivale Instrumentierung
Nach Erreichen eines Plaquestatus von unter 20% [7] folgte die subgingivale Instrumentierung unter Lokalanästhesie mit Hand- und Ultraschallinstrumenten, sowie wiederholten PVP-Iod Spülungen gemäß dem Protokoll der Universität Zürich in zwei Sitzungen innerhalb von 24 Stunden (23./24.02.2022) zusammen mit der Extraktion 18 und 38 [11]. Im Anschluss wurde der Patientin die Anwendung einer PVP-Iod-Spülung 3-mal täglich für zwei Wochen verordnet. Nachdem sie sich äußerst unglücklich mit der durch den Verlust von 31 entstandenen Lücke zeigte, wurde ein Diastemaschluss aus Komposit zum provisorischen Lückenschluss gefertigt (Abb. 8). Nach drei Monaten (23.05.2022) fand die erste Reevaluation statt (Abb. 9). Zusätzlich wurden dabei die Maßnahmen zur Mundhygiene unterstützt und eine PMPR mit gezielter subgingivaler Reinstrumentierung durchgeführt.
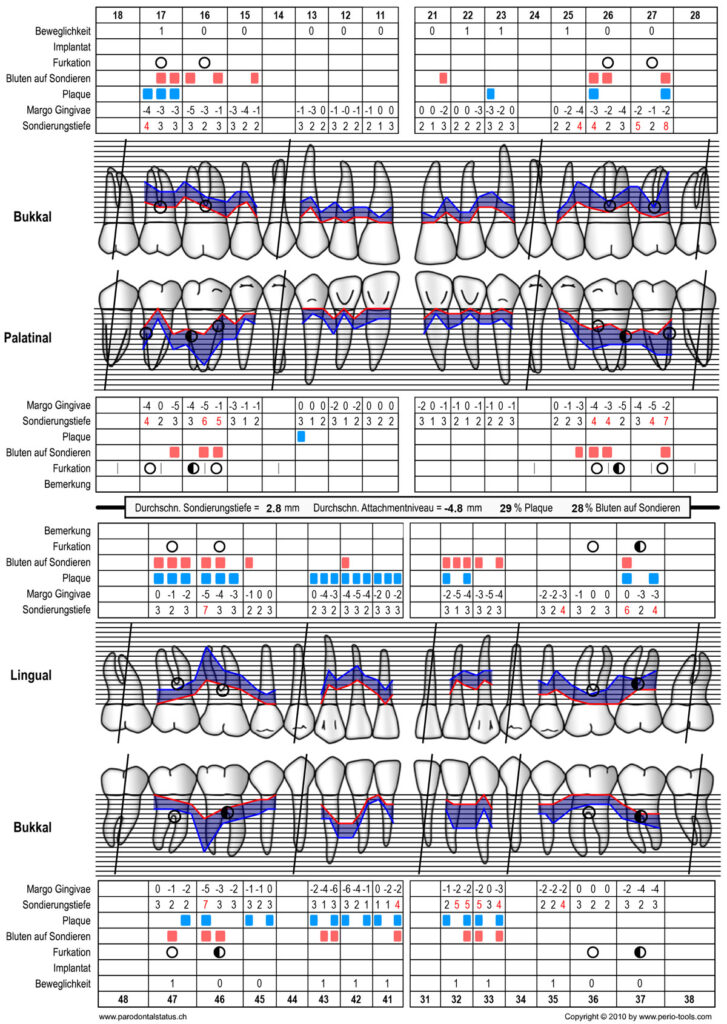
Abbildung 9 Parodontalstatus mit BoP [5] und Plaquestatus [6] zum Zeitpunkt der Reevaluation nach Stufe 1 der Therapie (23.05.2022)
Stufe 3 – Parodontalchirurgie
Der parodontale Befund bei der Reevaluation zeigte weiterhin eine gute Mundhygiene mit lokal erhöhten Sondierungstiefen von ≥ 6mm. Es wurde geplant, die Zähne 16 und 27 aufgrund
voraussichtlich fehlender tiefer infraossärer Defekte (≥ 3mm) und der koronal davon liegenden Furkationsdächer resektiv parodontalchirurgisch zu behandeln [12]. Für die Resttaschen distal des Zahns 46 und mesial 37 wurde auf weitere Heilung abgewartet [13].
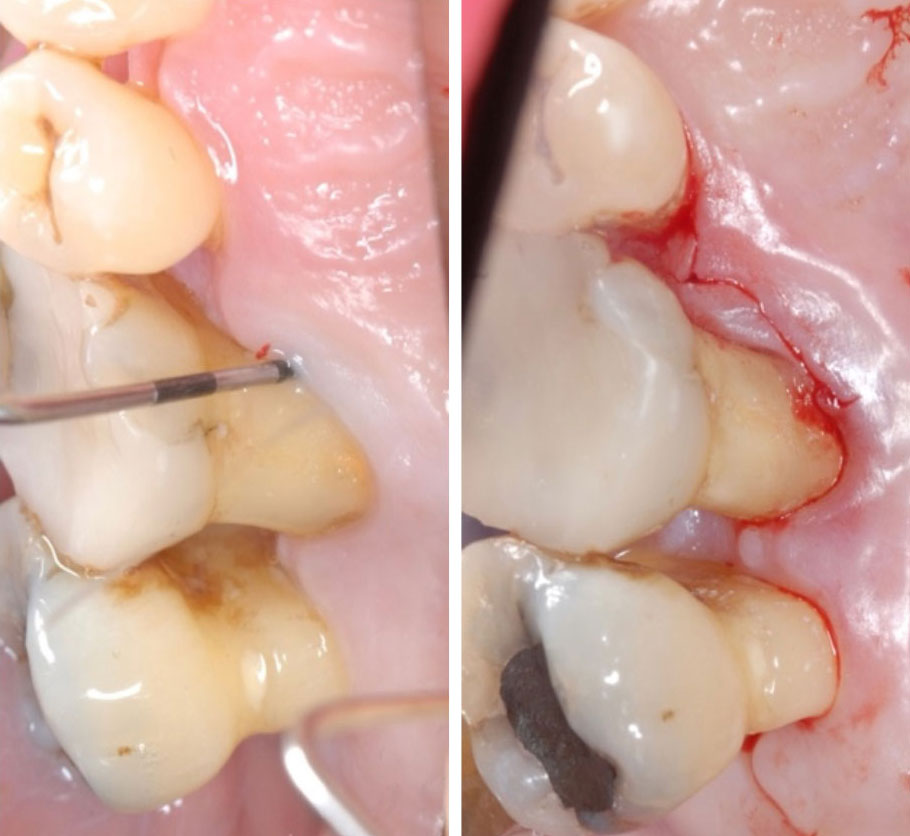
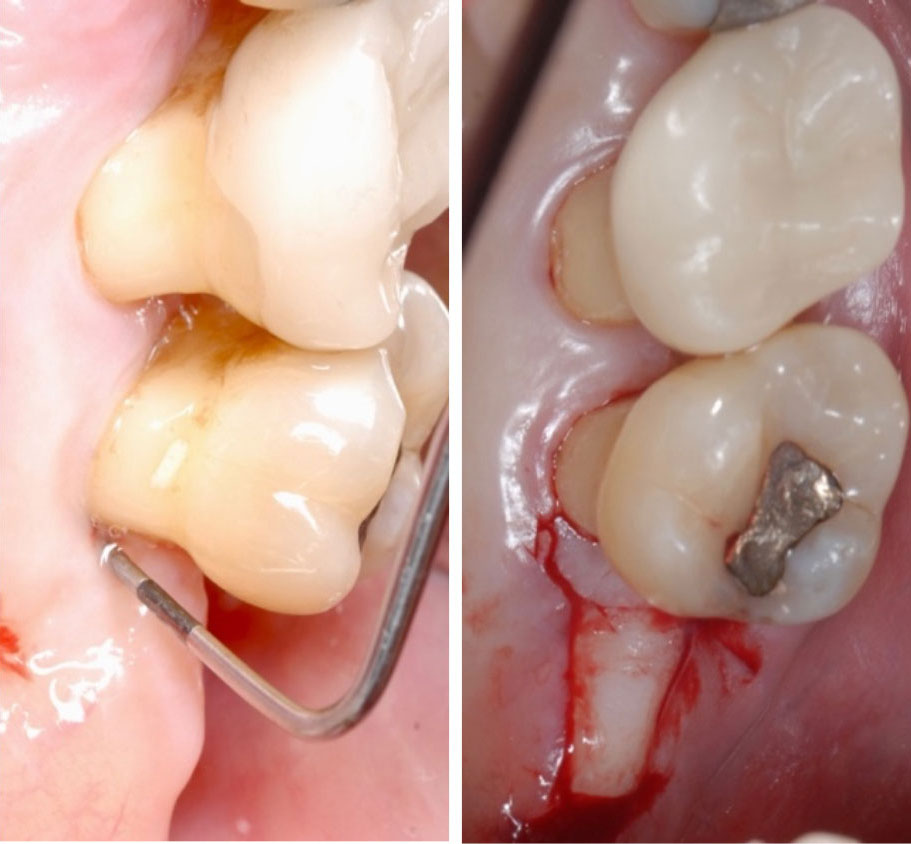
Abbildung 10 Modifizierte Widman Operation des Zahns 16 (initiale Sondierung und paramarginale Schnittführung)
Abbildung 11 Modifizierte distale Keilexcision des Zahns 27 (initiale Sondierung und Schnittführung)
Modifizierte Widman Operation 16
Nach Anhebung des Lappens mittels der modifizierten Widman-Lappen-Technik zeigte sich ein Furkationsdefekt Grad 1 ohne Restkonkremente [14]. Der flache Defekt wurde degranuliert, die Wurzeloberfläche mit rotierenden Instrumenten geglättet, der Furkationseingang abgeflacht und die Wunde verschlossen. Die Heilung erfolgte komplikationslos sekundär (Abb. 10).
Modifizierte distale Keilexzision 27
Distal von Zahn 27 wurde mittels einer modifizierten distalen Keilexzision das retromolare Gewebe ausgedünnt [15]. Nach Darstellung des Defekts wurde mittels einer Osteotomie eine positive Knochenkontur geschaffen, eine Odontoplastik im Furkationsbereich durchgeführt und der Lappen primär geschlossen. Die Wundheilung erfolgte ebenfalls ohne Komplikationen (Abb. 11). Die beiden chirurgischen Eingriffe wurden in einer Sitzung gemeinsam mit einer subgingivalen Instrumentierung der Resttaschen durchgeführt. Aufgrund des positiven mikrobiologischen Befunds für A. actinomycetemcomitans wurde adjuvant die modifizierte Dosierung des Van-Winkelhoff-Cocktails – Amoxicillin (500 mg für 7 Tage, 1-1-1) und Metronidazol (500 mg für 7 Tage, 1-1-1) – verwendet [16, 17].
Nach weiteren drei und sechs Monaten fanden erneute Reevaluationen gemäß dem zuvor beschriebenen Vorgehen statt (Abb. 12 und 13). Dabei zeigten sich die parodontalen Taschen überwiegend geschlossenen und der Anteil an Furkationsbeteiligungen Grad II reduziert [18, 19]. Insgesamt konnte die Patientin mit einem geringen Progressionsrisiko in die unterstützende Parodontitistherapie (UPT) entlassen werden.
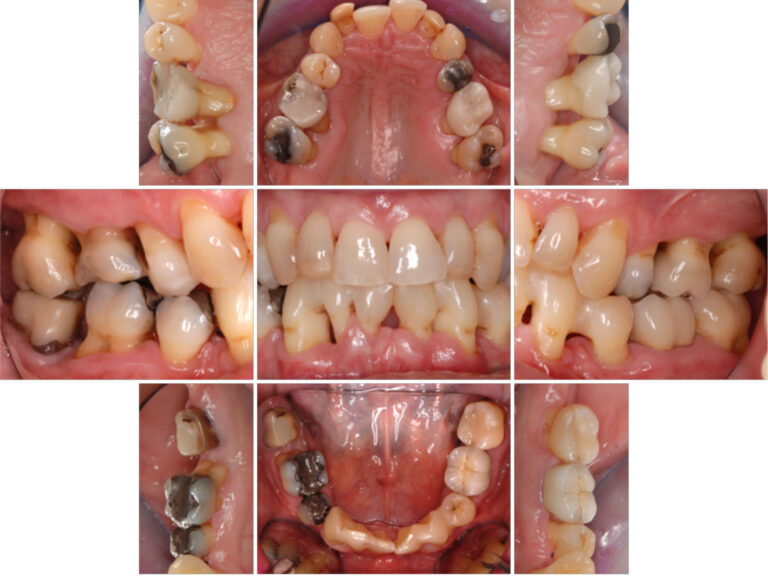
Abbildung 10 Klinische Bilder zum Zeitpunkt der Reevaluation 6 Monate nach Stufe 3 der Therapie (15.02.2023)
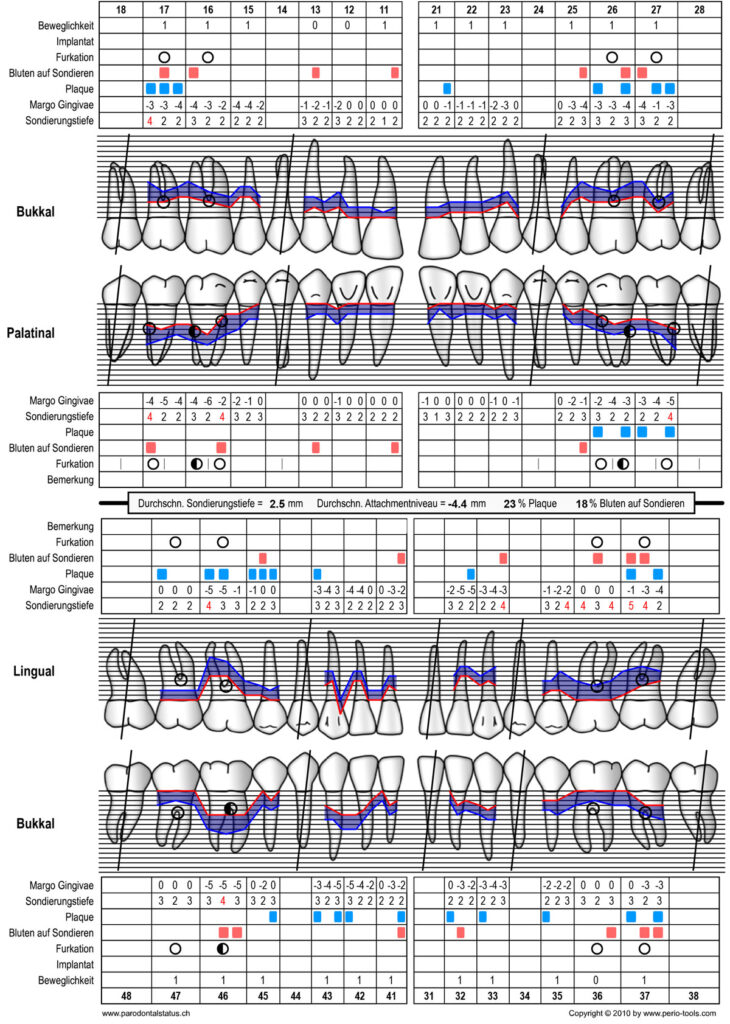
Abbildung 11 Parodontalstatus mit BoP [6] und Plaquestatus [7] zum Zeitpunkt der Reevaluation 6 Monate nach Stufe 3 der Therapie (15.02.2023)
Stufe 4 – Unterstützende Parodontitistherapie
Das UPT-Intervall wurde zunächst auf alle 3 Monate festgelegt. Die Gesamtsituation zeigte sich zum letzten Zeitpunkt stabil und Kontrollröntgenbilder im Bereich der Unterkieferfront bestätigen dies lokal anhand sich deutlich reossifizierender Bereiche (Abb. 14).
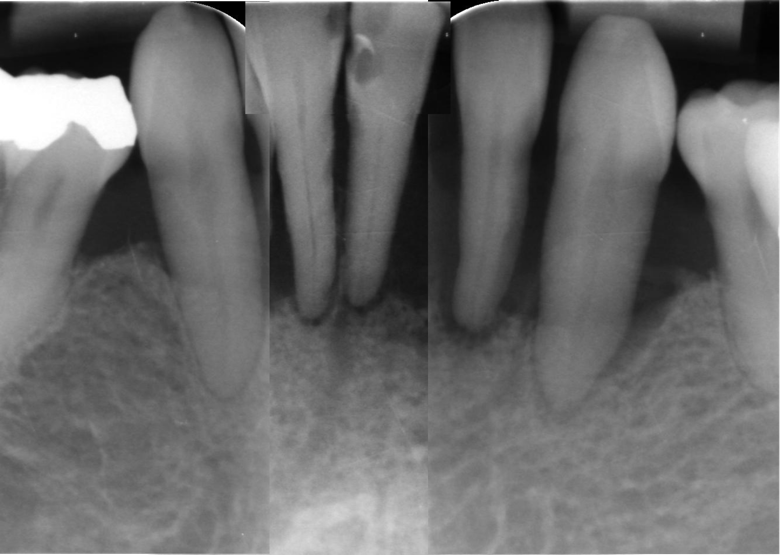
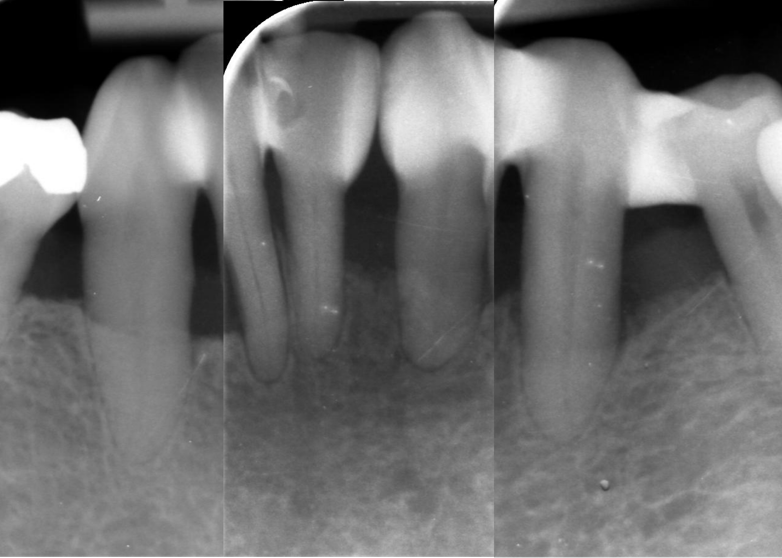
Abbildung 12 Röntgenbilder der Unterkieferfront zum Zeitpunkt des Ausgangbefundes am 23.08.2021 (links) und zur Nachkontrolle am 03.05.2023 (rechts)
Diskussion
Die Patientin stellte sich am Zentrum für Zahnmedizin der Universität Zürich mit einer generalisierten Parodontitis Stadium III Grad C vor. Die Therapie verlief insgesamt komplikationslos, und die parodontale Situation kann etwa ein Jahr nach der chirurgischen Therapie als stabil bezeichnet werden. Ein initialer Attachmentverlust von über 80% zeigt eine fortgeschrittene Parodontitis an, die sogar zur spontanen Avulsion des Zahns 31 führte. Dennoch können solche Zähne mit einer entsprechenden Therapie in den meisten Fällen langfristig erhalten werden [20]. Eine Schienung war aber unvermeidlich, trotz bekannter, jedoch leicht zu behebender Komplikationen wie Frakturen [21]. Der stetig positive Kältetest und Röntgenbilder des Vorbehandlers ließen eine rein parodontale Destruktion um die distale Wurzel von 46 wahrscheinlich erscheinen [22]. Durch eine vorsichtige subgingivale Instrumentierung konnte bisher eine endodontische Beteiligung vermieden werden. Dieser Aspekt wurde im Voraus mit der Patientin besprochen, und sie wurde angewiesen, sich bei pulpitischen Schmerzen frühzeitig zu melden. Das Vorgehen einer Full-Mouth-Therapie erreicht vergleichbare Ergebnisse wie das klassische quadrantenweise Vorgehen und wurde gemeinsam mit der Patientin bevorzugt [23]. Dabei wurde eine antibakterielle Spülung mit PVP-Iod angewandt, die eine weitere Verbesserung der klinischen Parameter gezeigt hat und auch einer Bakteriämie entgegenwirkt [11, 24, 25]. Im Rahmen von Stufe 3 der systematischen parodontalen Therapie ist eine adjuvante Antibiose nicht indiziert, um die Ergebnisse der chirurgischen Therapie zu verbessern [8, 26]. Angesichts des generell weit fortgeschrittenen Attachmentverlusts und der bisherigen hohen Progressionsrate (Grad C) ist es jedoch äußerst wichtig, eine weitere Progression zu verhindern. Das Vorhandensein von persistierendem A. actinomycetemcomitans wurde mit einer nicht erfolgreichen Parodontitistherapie und fortschreitendem Attachmentverlust in Verbindung gebracht [27, 28]. Die Verabreichung einer Kombination aus Amoxicillin und Metronidazol hat gezeigt, dass A. actinomycetemcomitans über einen Zeitraum von sechs Monaten unter die Nachweisgrenze gesenkt werden kann [29]. Im Bereich der Unterkieferfront zeigte sich eindrucksvoll eine Reossifikation horizontaler Defekte als Folge der nicht-chirurgischen Therapie, welche mittels chirurgischer Maßnahmen nicht zu erreichen ist [8].
Literaturverzeichnis
- Tonetti M.S.; Greenwell H., Kornman K.S. Staging and grading of periodontitis: Framework and proposal of a new classification and case definition. J Periodontol 2018, 89 Suppl 1, S159-S172.
- Miller S.C. Textbook of Periodontics. 1938:125.
- Hamp S.E.; Nyman S., Lindhe J. Periodontal treatment of multirooted teeth. Results after 5 years. J Clin Periodontol 1975, 2, 126-135.
- Tonetti MS, Sanz M. Implementation of the new classification of periodontal diseases: Decision-making algorithms for clinical practice and education. J Clin Periodontol 2019; 46: 398-405.
- McGuire M.K., Nunn M.E. Prognosis versus actual outcome. II. The effectiveness of clinical parameters in developing an accurat prognosis. J Periodontol 1996, 67, 658-665.
- Lang N.P.; Joss A.; Orsanic T.; Gusberti F.A., Siegrist B.E. Bleeding on probing. A predictor for the progression of periodonta disease. J Clin Periodontol 1986, 13, 590-596.
- O’Leary T.J.; Drake R.B., Naylor J.E. The plaque control record. J Periodontol 1972, 43, 38.
- Sanz M.; Herrera D. et al. Treatment of stage I-III periodontitis-The EFP S3 level clinical practice guideline. J Clin Periodonto 2020, 47 Suppl 22, 4-60.
- Worthington H.V.; MacDonald L. et al. Home use of interdental cleaning devices, in addition to toothbrushing, for preventing and controlling periodontal diseases and dental caries. Cochrane Database Syst Rev 2019, 4, CD012018.
- Lindhe J., Nyman S. The effect of plaque control and surgical pocket elimination on the establishment and maintenance periodontal health. A longitudinal study of periodontal therapy in cases of advanced disease. J Clin Periodontol 1975, 2, 67-79.
- Sahrmann P.; Imfeld T.; Ronay V.; Attin T., Schmidlin P.R. Povidone-iodine gel and solution as adjunct to ultrasonic debridemen in nonsurgical periodontitis treatment: an RCT pilot study. Quintessence Int 2014, 45, 281-290.
- Matuliene G.; Pjetursson B.E. et al. Influence of residual pockets on progression of periodontitis and tooth loss: results after 11 years of maintenance. J Clin Periodontol 2008, 35, 685-695.
- Badersten A.; Nilveus R., Egelberg J. Effect of nonsurgical periodontal therapy. II. Severely advanced periodontitis. J Clin Periodontol 1984, 11, 63-76.
- Ramfjord S.P., Nissle R.R. The modified widman flap. J Periodontol 1974, 45, 601-607.
- Robinson R.E. The distal wedge operation. Periodontics 1966, 4, 256-264.
- van Winkelhoff A.J.; Rodenburg J.P.; Goené R.J.; Abbas F.; Winkel E.G., de Graaff J. Metronidazole plus amoxycillin in the treatment of Actinobacillus actinomycetemcomitans associated periodontitis. J Clin Periodontol 1989, 16, 128-131.
- Guerrero A.; Griffiths G.S. et al. Adjunctive benefits of systemic amoxicillin and metronidazole in non-surgical treatment of generalized aggressive periodontitis: a randomized placebo-controlled clinical trial. J Clin Periodontol 2005, 32, 1096-1107.
- Wennström J.L.; Tomasi C.; Bertelle A., Dellasega E. Full-mouth ultrasonic debridement versus quadrant scaling and root planing as an initial approach in the treatment of chronic periodontitis. J Clin Periodontol 2005, 32, 851-859.
- Lang N.P., Tonetti M.S. Periodontal risk assessment (PRA) for patients in supportive periodontal therapy (SPT). Oral Health Prev Dent 2003, 1, 7-16.
- Pretzl B.; Kaltschmitt J.; Kim T.S.; Reitmeir P., Eickholz P. Tooth loss after active periodontal therapy. 2: tooth-related factors. J Clin Periodontol 2008, 35, 175-182.
- Sonnenschein S.K.; Betzler C.; Rütters M.A.; Krisam J.; Saure D., Kim T.S. Long-term stability of splinted anterior mandibular teeth during supportive periodontal therapy. Acta Odontol Scand 2017, 75, 475-482.
- Langeland K.; Rodrigues H., Dowden W. Periodontal disease, bacteria, and pulpal histopathology. Oral Surg Oral Med Oral Pathol 1974, 37, 257-270.
- Suvan J.; Leira Y.; Moreno Sancho F.M.; Graziani F.; Derks J., Tomasi C. Subgingival instrumentation for treatment of periodontitis. A systematic review. J Clin Periodontol 2020, 47 Suppl 22, 155-175.
- Sahrmann P.; Puhan M.A.; Attin T., Schmidlin P.R. Systematic review on the effect of rinsing with povidone-iodine during nonsurgical periodontal therapy. J Periodontal Res 2010, 45, 153-164.
- Sahrmann P.; Manz A.; Attin T.; Zbinden R., Schmidlin P.R. Effect of application of a PVP-iodine solution before and during subgingival ultrasonic instrumentation on post-treatment bacteraemia: a randomized single-centre placebo-controlled clinical trial. J Clin Periodontol 2015, 42, 632-639.
- Mombelli A.; Almaghlouth A.; Cionca N.; Courvoisier D.S., Giannopoulou C. Differential benefits of amoxicillin-metronidazole in different phases of periodontal therapy in a randomized controlled crossover clinical trial. J Periodontol 2015, 86, 367-375.
- Slots J., Rosling B.G. Suppression of the periodontopathic microflora in localized juvenile periodontitis by systemic tetracycline. J Clin Periodontol 1983, 10, 465-486.
- Van der Velden U.; Abbas F. et al. Java project on periodontal diseases. The natural development of periodontitis: risk factors, risk predictors and risk determinants. J Clin Periodontol 2006, 33, 540-548.
- Cionca N.; Giannopoulou C.; Ugolotti G., Mombelli A. Microbiologic testing and outcomes of full-mouth scaling and root planing with or without amoxicillin/metronidazole in chronic periodontitis. J Periodontol 2010, 81, 15-23.
